10 वी, विज्ञान I, मूलद्रव्यांचे आवर्ती वर्गीकरण भाग 2.
मूलद्रव्यांचे आवर्ती वर्गीकरण 1
@@@@----@@@@
आज आपण आधुनिक आवर्तसारणी ची रचना पाहणारा आहोत. मेंडेलीव्हच्या आवर्तसारणी मध्ये जे दोष राहिले होते ते दोष दूर करण्यासाठी मोजले या शास्त्रज्ञाने अणुअंकाचा आधार घेतला. मूलद्रव्यांची मांडणी अणू-अंकाच्या चढत्या क्रमाने करून दीर्घ श्रेणी आवर्त सारणी तयार केली.
दीर्घ श्रेणी आवर्त सारणी चे चार खंड केले s-खंड , p-खंड , d-खंड , f- खंड.
दीर्घ श्रेणी आवर्त सारणी मध्ये 118 चौकटी आहेत , म्हणजेच यात 118 मूलद्रव्यासाठी जागा आहे.
* s- खंड
1. एस खंड हा गण 1 (उदा . सोडियम Na ,पोटॅशियम K) व गण 2 यांचा बनलेला आहे. ( उदा. मॅग्नेशियम Mg , कॅल्शियम Ca)
2. s- खंडामध्ये धातू मूलद्रव्य आहेत.
3. सामान्य तापमानाला ही मूलद्रव्य स्थायू अवस्थेत असतात.
4. गण 1 ला अल्क धातू असे म्हणतात. ( अल्क धातू म्हणजे जे धातू पाण्यात विरघळल्यावर त्यांचे हायड्रॉक्साइड तयार होतात
उदा.Na + H2O = NaOH (aq)
aq - म्हणजे जलीय / aqueous.
4.गण 2 ला अल्कधर्मी मृदा धातू असे म्हणतात.
▬▬▬۩۞۩▬▬▬
* p-खंड :-
1.गण 13 ते गण 18 यामधील मूलद्रव्यांना p-खंडातील मूलद्रव्य असे म्हणतात.
2. P-खंडात धातू , अधातू व धातुसदृश्य अशा तीनही प्रकारची मूलद्रव्य आढळतात.
3. P-खंडातील मूलद्रव्य ही स्थायू , द्रव (ब्रोमीन Br) आणि वायू अवस्थेत आढळतात.
4. P-खंडात गण 17 ही हॅलोजन मूलद्रव्य आढळतात. हॅलोजन्स म्हणजे आम्ल तयार करणारी. उदा. HCl, HBr.
5. P-खंडात निष्क्रिय वायू मूलद्रव्य 18 गणात आढळतात. उदा. हेलियम He, निऑन Ne , ऑर्गन Ar , क्रिप्टॉन Kr , झेनॉन Xe.
6. p-खंडात नागमोडी रेषेच्या किनारीने धातुसदृश्य मूलद्रव्य आहेत. उदा सिलिकॉन Si , आर्सेनिक As , अँटीमनी Sb. नागमोडी रेषेच्या उजवीकडे अधातू तर डावीकडे धातू मूलद्रव्य आहेत.
▬▬▬۩🎺۩▬▬▬
* सामान्य मूलद्रव्य :-
- व्याख्या:ज्या मूलद्रव्यांच्या अणूची केवळ शेवटची एकच कक्षा इलेक्ट्रॉन ने अपूर्ण असते व इतर सर्व कक्षा इलेक्ट्रॉन ने पूर्णपणे भरलेले असतात त्यांना सामान्य मूलद्रव्य असे म्हणतात. उदा. Na - 2,8,1 सोडियमची शेवटची एक कक्षा अपूर्ण आहे.
- गण:गण 1 व गण 2 आणि 13 ते 17 गणातील मूलद्रव्यांना सामान्य मूलद्रव्य असे म्हणतात.
- क्रियाशीलता:ही मूलद्रव्य रासायनिक दृष्ट्या क्रियाशील आहेत.
- स्थान: दीर्घ श्रेणी आवर्त सारणी मध्ये हे एकदम डावीकडे व एकदम उजवीकडे आहेत.
▬▬▬۩🦅۩▬▬▬
* संक्रमण मूलद्रव्य :-
ज्या मूलद्रव्यांच्या अणूंच्या शेवटच्या दोन कक्षा इलेक्ट्रॉनिक अपूर्ण असतात व इतर सर्व कक्षा इलेक्ट्रॉनिक पूर्णपणे भरलेले असतात त्यांना संक्रमण मूलद्रव्य असे म्हणतात. उदा. Fe - 2,8,14,2 लोह म्हणजेच आयर्न या मूलद्रव्याच्या शेवटच्या दोन कक्षा इलेक्ट्रॉनिक अपूर्ण आहेत.
गण 3 ते 12 या गणातील मूलद्रव्यांना संक्रमण मूलद्रव्य असे म्हणतात. पारा / मर्क्युरी Hg हा द्रव अवस्थेत असून इतर सर्व मूलद्रव्य स्थायू अवस्थेत आहेत. ही जड धातू मूलद्रव्य आहेत.
या मूलद्रव्यांची ' d ' ही कक्षा इलेक्ट्रॉन ने अपूर्ण असते. ही मूलद्रव्ये रंगीत संयुगे तयार करतात. ही मूलद्रव्य जड धातू मूलद्रव्य आहेत.
▬▬▬۩🎸۩▬▬▬
* अंतर संक्रमण मूलद्रव्य :-
ज्या मूलद्रव्यांच्या अणूंच्या शेवटच्या तीन कक्षा इलेक्ट्रॉन ने अपूर्ण असतात व शेवटचा इलेक्ट्रॉन हा f कक्षेत येतो त्यांना अंतर संक्रमण मूलद्रव्य असे म्हणतात. उदा. La - 2,8,18,18,9,2
कवच. n इलेक्ट्रॉन धारकता
K 1 2
L 2 8
M 3 18
N 4 32
दीर्घ श्रेणी आवर्तसारणीच्या तळाशी सहाव्या व सातव्या आवर्तनात , तिसऱ्या गण स्वतंत्र दोन मालिका आहेत त्या मालिकांना लॅन्थेनाइड व अॅक्टिनाइड असे संबोधतात.
ही मूलद्रव्ये धातू मूलद्रव्य आहेत. ही मूलद्रव्ये उष्णता व विद्युत यांचे सुवाहक आहेत. Actin मालिकेतील मूलद्रव्य किरणोत्सारी आहेत.
यातील बहुतेक मूलद्रव्य हे मानवनिर्मित आहेत यांची क्रियाशीलता खूप जास्त आहे.
* कोणत्याही गणात वरून खाली जाताना मूलद्रव्यांची विद्युत घनता वाढत जाते तर विद्युत ऋणता कमी होत जाते.
* कोणत्याही आवर्तात डावीकडून उजवीकडे जाताना मूलद्रव्यांची विद्युत ऋणता वाढत जाते तर विद्युत धनता कमी होत जाते.
* मूलद्रव्याची विद्युत धनता किंवा विद्युत ऋणता जेवढी जास्त तेवढी त्याची अभिक्रियाशीलता जास्त.
▬▬▬۩🪘۩▬▬▬
* अणु आकार
अणु त्रिज्या म्हणजे अनु केंद्र व बाह्यतम कवच यामधील अंतर होय. अणु त्रिज्या ही पिकोमीटर pm या एककात दर्शवतात
आवर्तामध्ये डावीकडून उजवीकडे जाताना अणु त्रिज्या ही कमी कमी होत जाते कारण अणुअंक वाढत जातो म्हणजेच केंद्रका वरील धनप्रभार एक एक ने वाढत जातो. पण त्याच सोबत इलेक्ट्रॉन बाह्यतम कक्षेत जमा होतात . वाढीव केंद्रकीय धनप्रभारामुळे इलेक्ट्रॉन केंद्रकाकडे अधिक प्रमाणात आकर्षिले/ ओढले जातात त्यामुळे अणुचा आकार कमी होतो.
* गणात वरून खाली जाताना अणु चा आकार हा वाढत जातो कारण एक एक ने कक्षा वाढत जाते, कक्षेत भर पडल्यामुळे आकारमान वाढते. उदा .
▬▬▬۩🤞۩▬▬▬
* हॅलोजन कुल.
दीर्घ श्रेणी आवर्तसारणीतील गण 17 ला हॅलोजन कुल असे संबोधतात यामध्ये फ्लोरिंग क्लोरीन ब्रोमीन आयोडीन एस्टटाईल ही मूलद्रव्ये आढळतात. भौतिक अवस्थेचा विचार करता फ्ल्यू ओरीन व क्लोरीन ही वायुरूप ब्रोमीनद्रवरू तर आयोडीन हा स्थायुरूपात आढळतो.
हॅलोजन म्हणजे आम्ल तयार करणारा.
▬▬▬۩⛽۩▬▬▬
* निष्क्रिय वायू मूलद्रव्य :-
- स्थान: दीर्घ श्रेणी आवर्तसारणीच्या एकदम उजव्या भागात, गण 18 मध्ये ही मूलद्रव्ये आढळतात.
- ओळख: यांना राजवायू असे पण म्हणतात. शून्य गणातील मूलद्रव्य, नोबल गॅस अशी पण नावे आहेत.
- वैशिष्ट्य: या मूलद्रव्यांचे अष्टक पूर्ण असल्यामुळे ही मूलद्रव्य रासायनिक अभिक्रियेत इलेक्ट्रॉन देत नाहीत, घेत नाहीत व इलेक्ट्रॉनची भागीदारी करत नाहित.
- अवस्था: सामान्य तापमानाला ही मूलद्रव्य वायू अवस्थेत असतात.
🎻 प्रश्न छोटेच व उत्तरही छोटेच पण..... उत्तर भारी. काही स्वाध्याय मधील प्रश्न.
1. K, L, M ह्या कवचामध्ये इलेक्ट्रॉन असलेला आवर्त period.
उत्तर. तिसरे आवर्त.
2. शून्य संयुजा असलेला गण.
उत्तर :- गण 18.
3. संयुजा एक असलेल्या अधातूचे कुल.
उत्तर :- हॅलोजन कुल / गण 17
4. संयुजा एक असलेल्या धातूचे कुल.
उत्तर :- गण 1.
5. संयुजा 2 असलेल्या धातूचे कुल.
उत्तर :- गण 2.
6. दुसऱ्या व तिसऱ्या आवरता मधील धातुसदृश्य.
उत्तर:- बोरॉन B , सिलिकॉन Si.
7. तिसऱ्या आवर्तमधील मधील अधातु.
उत्तर :- फॉस्फरस P, गंधक S , क्लोरीन Cl , अरगॉन Ar .
8. संयुजा 4 असलेली दोन मूलद्रव्य.
उत्तर :- कार्बन C , सिलिकॉन Si.
9. पहिले दोन निष्क्रिय वायू मूलद्रव्य.
उत्तर :- हेलियम He , निऑन Ne.
10 . संयुजा दोन असलेल्या धातूंचा कुल.
उत्तर :- गण 2.
11. संयुजा तीन असलेला एक धातू.
उत्तर :- अल्युमिनियम (Al = 2,8,3.)
▬▬▬۩⚜️۩▬▬▬
* वर्णनावरून मूलद्रव्याचे नाव व संज्ञा लिहिणे.
1. सर्वात लहान आकारमानाचा अणु.
उत्तर :- हायड्रोजन H.
2. सर्वात कमी अणुवस्तुमानाचा अणू.
उत्तर :- हायड्रोजन H.
3. सर्वाधिक विद्युत ऋण अणू.
उत्तर :- फ्ल्युओरिन F.
4. सर्वात कमी अणु त्रिज्या असलेला राजवायू.
उत्तर :- हेलियम He.
5. सर्वाधिक अभिक्रियाशील अधातू.
उत्तर :- फ्ल्युओरिन F .
मूलद्रव्यांचे आवर्ती वर्गीकरण या पाठावर MCQ परीक्षा देण्यासाठी निळ्या लिंकला स्पर्श करा. ✍️👇
👉 मूलद्रव्यांचे आवर्ती वर्गीकरण
*
जेव्हा सर्व काही व्यवस्थित आहेहे तुम्ही जाणता
तेव्हा तुम्ही शांततेने
डोके मागे करून नक्कीच आकाशाकडे पाहता. हाच खरा आनंद.*
*बरंच काही असण्यात आनंद नाही, तर असलेल्या गोष्टी वाटण्यात आनंद आहे.*
*कोणत्याही गोष्टी वाटल्याने आनंद कमी होत नसतो तर तो वाढतो.*
*आपला दिवस आनंदी जावो.🎷

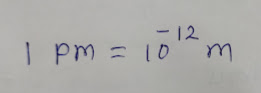


छान मांडणी सर
उत्तर द्याहटवा